CORRIGE de Chimie
Asie - Section S - Juin 2007
Des esters dans nos cosmétiques
I] Les parabènes
1.1)
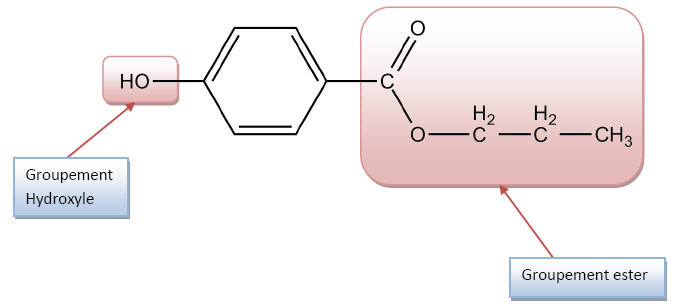
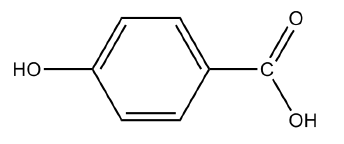
1.2) La formule
semi-développée de l’acide para-hydroxybenzoïque est :
1.3) Le réactif n°2 est le
propan-1-ol de formule semi-développée :
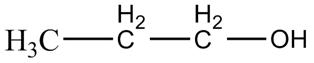
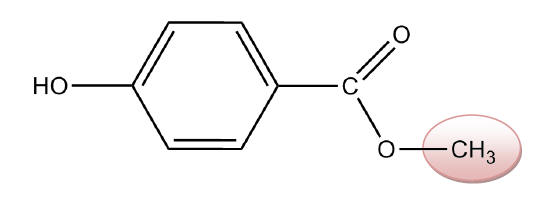
1.4) Le
méthylparaben est la molécule c) car elle possède un
groupement méthyle (-CH3).
II] Préparation d’un
ester utilisé en parfumerie
2.1) Recherche de l’
acide carboxylique utilisé :
2.1.1) Equation de la réaction
support du dosage :
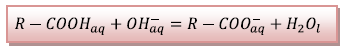
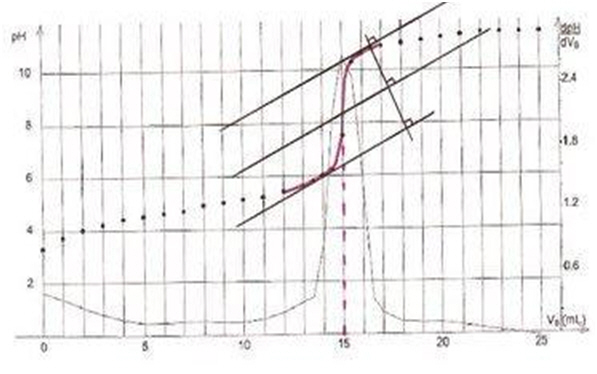
2.1.2) La dérivée 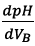 présente
un maximum à l’équivalence. On lit sur le graphe
présente
un maximum à l’équivalence. On lit sur le graphe 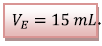 .
.
On peux également utiliser la
méthode des tangentes :
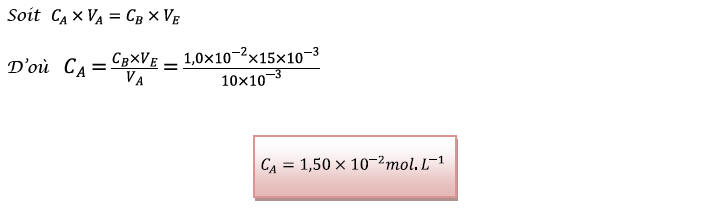
2.1.4) Masse molaire de
l’acide carboxylique utilisé :
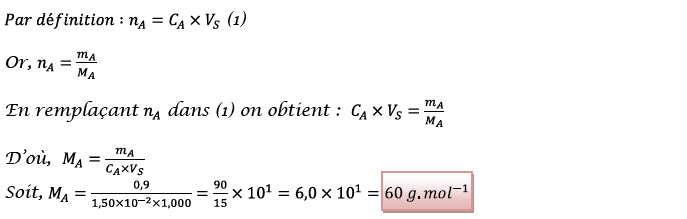
D’après les données
fournies en fin d’énoncé, l’acide carboxylique A
utilisé correspond à l’acide éthanoïque.
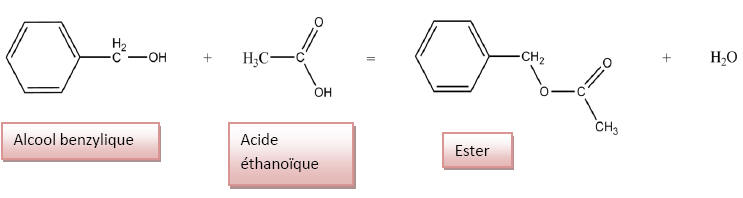
2.2) Synthèse de
l’ester :
2.2.1) Equation de la réaction correspondant à la
préparation de l’ester :
2.2.2) La réaction
d’estérification est lente, limitée.
2.2.3) On ajoute de l’acide sulfurique concentré
dans le milieu réactionnel pour augmenter la vitesse
de la réaction. En effet, l’acide sulfurique sert de
catalyseur à la réaction.
2.2.4) Le montage proposé est un montage de
chauffage à reflux. Le réfrigérant à boules
permet la récondensation des vapeurs issues du
milieu réactionnel afin d’éviter la perte de
matière. Le chauffe-ballon permet quant à lui
d’augmenter la température du milieu réactionnel
afin d’augmenter la vitesse de réaction (la
température est un facteur cinétique).
2.3) Extraction
de l’ester préparé :
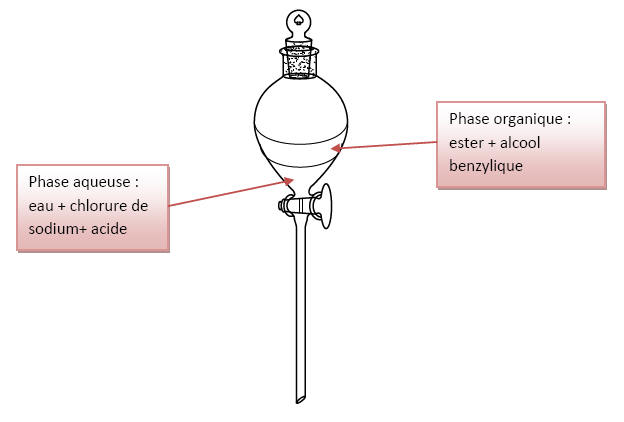
2.3.1) L’ester synthétisé se trouve dans la phase
organique car il est très peu soluble dans l’eau
salée.
La masse volumique de
l’ester est 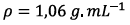 est
inférieure à celle de l’eau salée (
est
inférieure à celle de l’eau salée ( 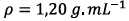 )
donc la phase organique se situe au-dessus de la
phase aqueuse salée.
)
donc la phase organique se situe au-dessus de la
phase aqueuse salée.
2.3.2) Le mélange étant
stœchiométrique et les coefficients
stœchiométriques étant égaux à 1, si la réaction
est totale on obtiendra une quantité d’ester égale à
:
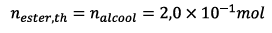
Or, le rendement vaut 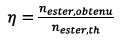
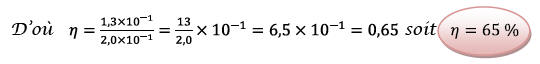
2.3.3) Pour améliorer le
rendement sans changer les réactifs on peut :
![]() Mettre en excès l’un des réactifs.
Mettre en excès l’un des réactifs.
![]() Enlever
un produit au fur et à mesure de sa formation par
exemple l’eau.
Enlever
un produit au fur et à mesure de sa formation par
exemple l’eau.
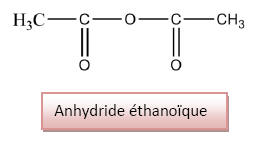
2.3.4) On peut améliorer
le rendement en remplaçant l’acide éthanoïque par
son anhydride d’acide : l’anhydride étanoïque. Ainsi
la réaction devient totale et rapide.