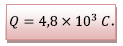CORRIGE de Chimie
Antilles Guyane - Section S - Juin 2004
Durée de fonctionnement d'une pile Cuivre-Aluminium
1)
Schéma annoté de la pile :
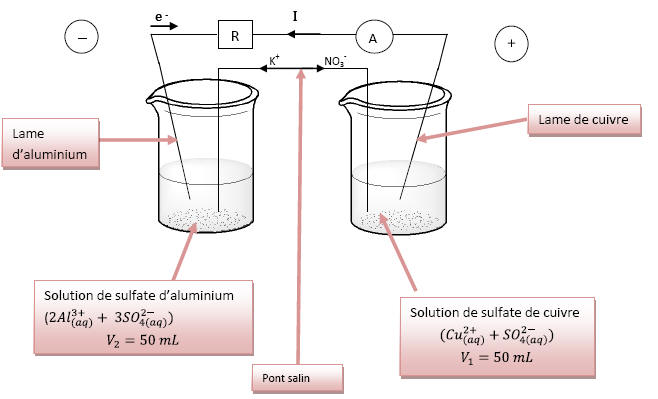
2)L’ampèremètre indique que le courant circule de la
lame de cuivre vers la lame d’aluminium à
l’extérieur de la pile or par convention le courant
de borne + vers la borne -.
On en déduit que la lame de cuivre correspond à la
borne + et que la lame d’aluminium est le pôle
- de
la pile.
3)
Equations aux électrodes :
![]() A l’électrode de cuivre, il se produit une réduction
des ions
A l’électrode de cuivre, il se produit une réduction
des ions
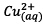 (cathode)
:
(cathode)
:
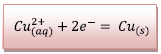
![]() A l’électrode d’aluminium, il se produit une
oxydation de lame d’aluminium (anode) :
A l’électrode d’aluminium, il se produit une
oxydation de lame d’aluminium (anode) :

4)
Equation de fonctionnement de la pile est :
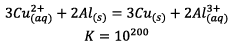
a)Quotient initial de réaction :
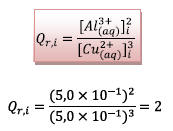
b) On remarque que
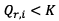 donc
le sens d’évolution du système étudié est cohérent :
le système évolue dans le sens direct.
donc
le sens d’évolution du système étudié est cohérent :
le système évolue dans le sens direct.
5)
Etude de la pile en fonctionnement
:
a)
Quantités de matière initiales en moles des
réactifs :
![]() les ions cuivre :
les ions cuivre :
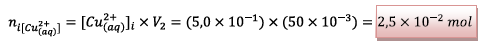
![]() L’aluminium :
L’aluminium :
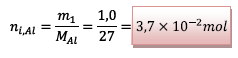
Tableau d’avancement :
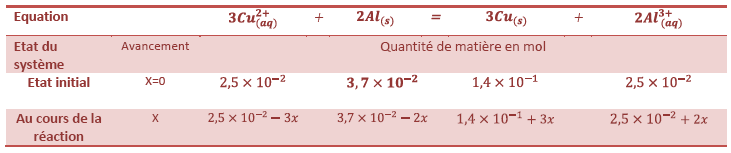
Détermination de l’avancement maximal
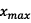 :
:
![]() Si
Si
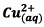 est
le réactif limitant alors on a :
est
le réactif limitant alors on a :
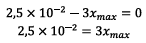
D’où
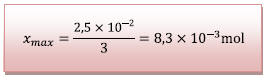
![]() Si
Si
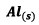 est
le réactif limitant alors on a :
est
le réactif limitant alors on a :
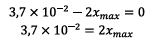
D’où
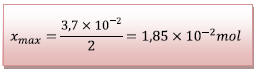
Conclusion :
le réactif limitant est
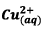 car
il
conduit à l’avancement maximal le plus faible donc :
car
il
conduit à l’avancement maximal le plus faible donc :

b)
Quantité maximale d’électricité que peut débiter la
pile :
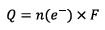
D’après La demi-équation qui à lieu à l’électrode de
cuivre à chaque fois qu’un ion
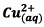 est
consommé deux électrons circulent dans la pile.
D’après l’équation de la réaction, au cours de la
réaction 3 molécules de
est
consommé deux électrons circulent dans la pile.
D’après l’équation de la réaction, au cours de la
réaction 3 molécules de
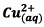 sont
consommées à chaque fois et donc 6 électrons sont
transférés au circuit extérieur.
sont
consommées à chaque fois et donc 6 électrons sont
transférés au circuit extérieur.
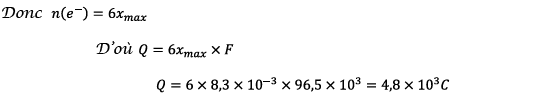
La quantité maximale
d’électricité que peut débiter la pile est