CORRIGE de Chimie
France Métropolitaine - Section S - Septembre 2003
L'arôme de banane
I] Composé naturel ou
composé artificiel
Les raisons qui font qu’un industriel puisse plutôt avoir recours à l’utilisation du composé artificiel sont :
![]() Le coût de revient
Le coût de revient
![]() La rareté du produit à l’état naturel
La rareté du produit à l’état naturel
II] Questions préliminaires
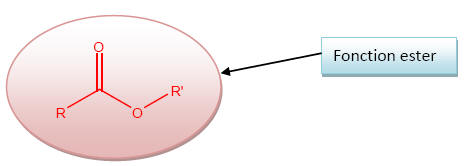
1) L’acétate de butyle appartient à la famille des esters car il possède le groupement caractéristique des esters.
2) L’équation associée à la réaction de synthèse de l’acétate de butyle (E) est :
A + B
= E + H2O
La réaction de synthèse d’un ester fait intervenir comme produit un alcool (B) et un acide carboxylique (A).
L’alcool est le butan-1-ol et l’acide carboxylique est l’acide acétique d’après le nom de l’ester formé. En effet, la première partie du nom, terminée par le suffixe « oate », qui décrit la chaîne carbonée principale provenant de l’acide et la deuxième, terminée par le suffixe « yle » qui décrit la chaîne carbonée provenant de l’alcool.
(Ici le nom conventionnel de l’ester est : l’éthanoate de butyle)
III] Synthèse de
l’acétate de butyle au laboratoire
1) Le bain d’eau glacée permet de bloquer la cinétique de la réaction en effectuant une trempe car la température est un facteur cinétique. Ainsi la réaction ne débutera que lorsque que le chimiste le décidera.
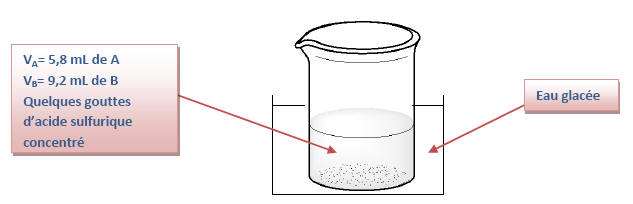
2) L’acide sulfurique sert
de catalyseur à la réaction. Il permet d’augmenter
la vitesse de réaction mais ne change en aucun cas
la quantité de produit formé.
Ainsi, il permet d’atteindre plus rapidement
l’équilibre sans le modifier.
Le catalyseur n’apparaît pas dans le bilan global de
la réaction.
3) na = 0,1 mol
On a 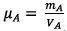 donc mA = µA
VA (2)
donc mA = µA
VA (2)
On injecte (2) dans (1) d’où
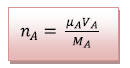
4) On choisit de traiter
la question à l’aide d’un tableau d’avancement lié à
la réaction d’estérification.
Le mélange initiale {acide + alcool} est équimolaire
signifie qu’on introduit la même quantité de matière
d’acide et d’alcool.
D’où
nA = nB = 0,1 mol
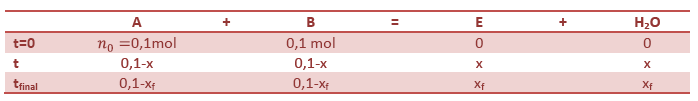
L’avancement maximal est
noté xmax.
L’avancement est maximal si la réaction est totale
c’est-à-dire si le réactif limitant est totalement
consommé.
Ici
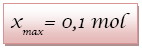
IV] Suivi de la
synthèse par titrage de l’acide restant
1) L’indicateur coloré permet de repérer l’équivalence acido-basique par un changement de couleur de la solution.
2) Le volume Veq diminue au cours du temps pour atteindre une valeur constante à t=60 min. En effet, la soude réagit avec l’acide acétique (et l’acide sulfurique) mais la quantité d’acide diminue au cours du temps car il est consommé par la réaction pour produire l’ester. C’est pourquoi le volume de soude Veq nécessaire pour le doser diminue également. Mais à partir de t=60 min la valeur de Veq reste constante car la réaction a atteint son équilibre.
3) 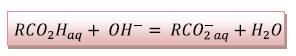
L’équivalence d’un dosage
correspond au moment où les réactifs du titrage sont
introduits dans les proportions stœchiométriques
(on introduit juste assez de réactif titrant pour
consommer toutes les molécules de réactifs titré).
Le réactif titré devient le réactif limitant.
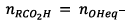
Or
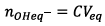
Donc à t,
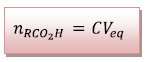
5) Les réactifs sont introduits dans
les proportions stœchiométriques et le mélange est
équimolaire donc d’après le tableau d’avancement de
la question III-4 la quantité d’ester formé est :
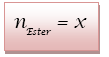
6) x est la quantité de
matière de 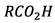 ayant
réagit pendant la durée t pour le mélange initial.
ayant
réagit pendant la durée t pour le mélange initial.
Pour un tube on a :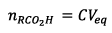 (question
4)
(question
4)
Or le mélange initial
contient 10 fois plus dacide que chaque tube à
essai donc :
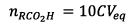
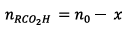
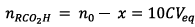

V] Evolution temporelle
de l’avancement de la synthèse organique
D’après la question III-4 on a
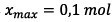
Or
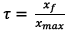
Donc
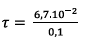
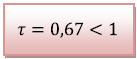
2) Justification des deux
propositions :
![]() La transformation chimique est lente :
graphiquement on s’aperçoit que la réaction atteint
son équilibre (xf ) au bout d’une durée
t=60min.
La transformation chimique est lente :
graphiquement on s’aperçoit que la réaction atteint
son équilibre (xf ) au bout d’une durée
t=60min.
![]() La transformation chimique n’est pas
totale car le taux d’avancement
La transformation chimique n’est pas
totale car le taux d’avancement
![]() est
inférieur à 1 donc le réactif limitant n’est
pas totalement consommé.
est
inférieur à 1 donc le réactif limitant n’est
pas totalement consommé.
3) Au niveau macroscopique
lorsqu’un système est dans un état d’équilibre les
concentrations des espèces présentes (réactifs et
produits) sont constantes.
En revanche, au niveau microscopique le milieu
réactionnel est le siège d’une activité chimique
permanente, ici les réactions d’hydrolyse et
d’estérification ont des vitesses de réaction
identiques donc on a un équilibre
dynamique.
4) a)
![]() En augmentant la température du milieu
réactionnel on peut accélérer la synthèse de
l’acétate de butyle. En effet, la température est un
facteur cinétique.
En augmentant la température du milieu
réactionnel on peut accélérer la synthèse de
l’acétate de butyle. En effet, la température est un
facteur cinétique.
![]() Pour augmenter le taux d’avancement à
l’équilibre on peut soit mettre un réactif en excès,
soit éliminer un produit au fur et à mesure qu’il
est produit on déplace ainsi l’équilibre dans le
sens direct.
Pour augmenter le taux d’avancement à
l’équilibre on peut soit mettre un réactif en excès,
soit éliminer un produit au fur et à mesure qu’il
est produit on déplace ainsi l’équilibre dans le
sens direct.
b) Pour synthétiser l’acétate de butyle par une transformation chimique totale et rapide on peut remplacer l’acide éthanoïque par l’anhydride éthanoïque :